中国人民解放军总医院阎丽教授和东华大学张耀鹏教授团队研究成果
本研究利用4K-DLP微纳米3D打印技术制备与急性肝损伤力学性能匹配的丝素蛋白支架(3D-SF),并负载脂肪间充质干细胞(ADSCs@3D-SF)。体外研究证实3D-SF可以促进ADSCs黏附、增殖及向肝细胞样细胞分化;体内研究显示支架移植后可以有效改善急性肝损伤(ALI)小鼠肝功能并修复组织结构,ADSCs@3D-SF可诱导血管及胆管样结构形成,并激活Wnt信号通路,促进细胞增殖,修复急性肝损伤。ADSCs@3D-SF为急性肝损伤修复提供了一种具有重要意义的新型组织工程策略。
本研究以丝素蛋白(SF)为原料,通过甲基丙烯酸缩水甘油酯(GMA)化学修饰获得光敏化生物墨水,并采用4K 高分辨率数字光处理(DLP)3D 打印技术制备出结构规则、孔径均一(100 μm)、力学性能匹配受损肝组织的三维支架。3D-SF具有良好的机械性能(12 kPa)、结构高度多孔(44%)、酶降解依赖性明显等特性,满足肝脏组织工程需求(图1,图2)。
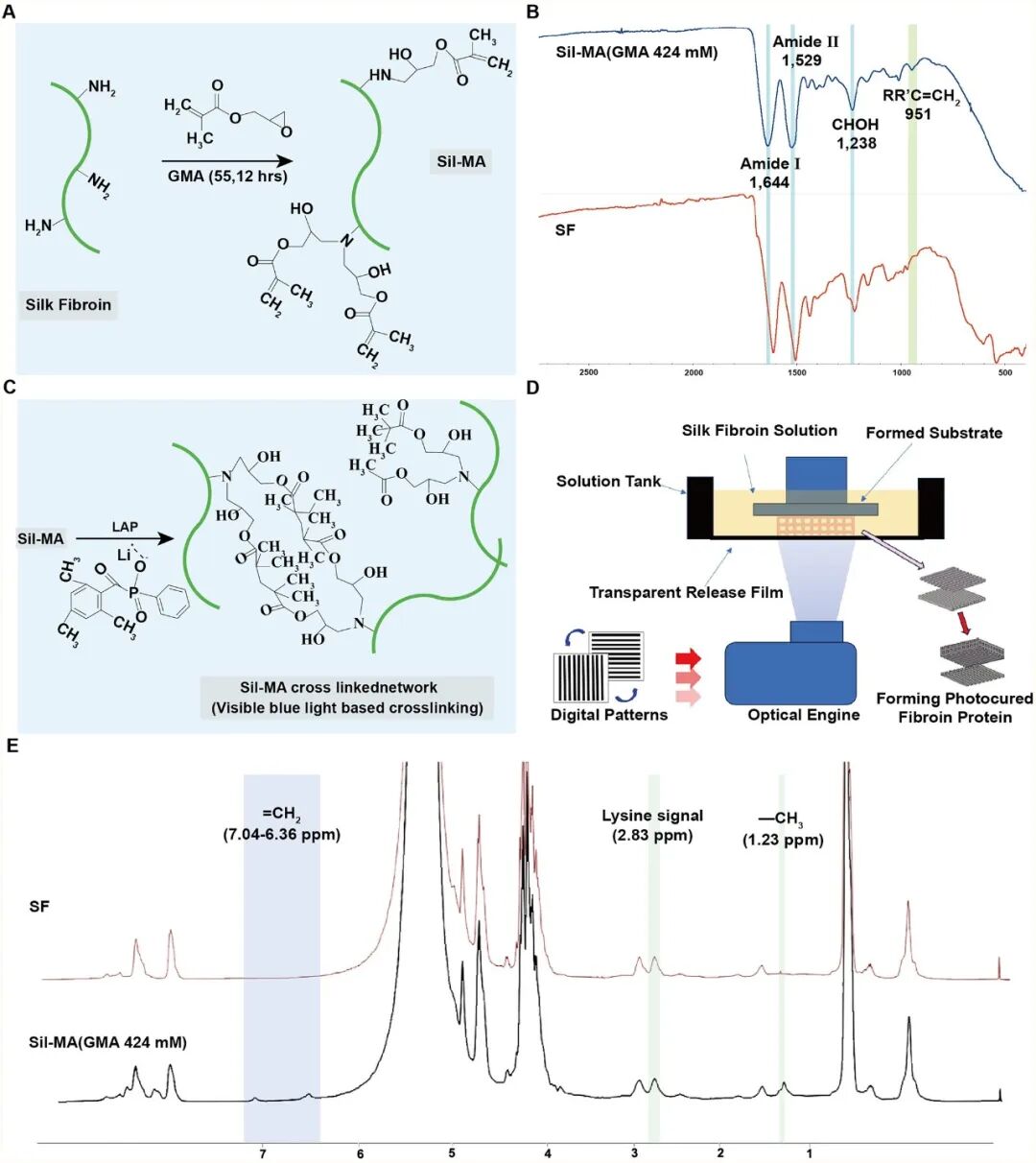
图1 Sil-MA 的合成过程
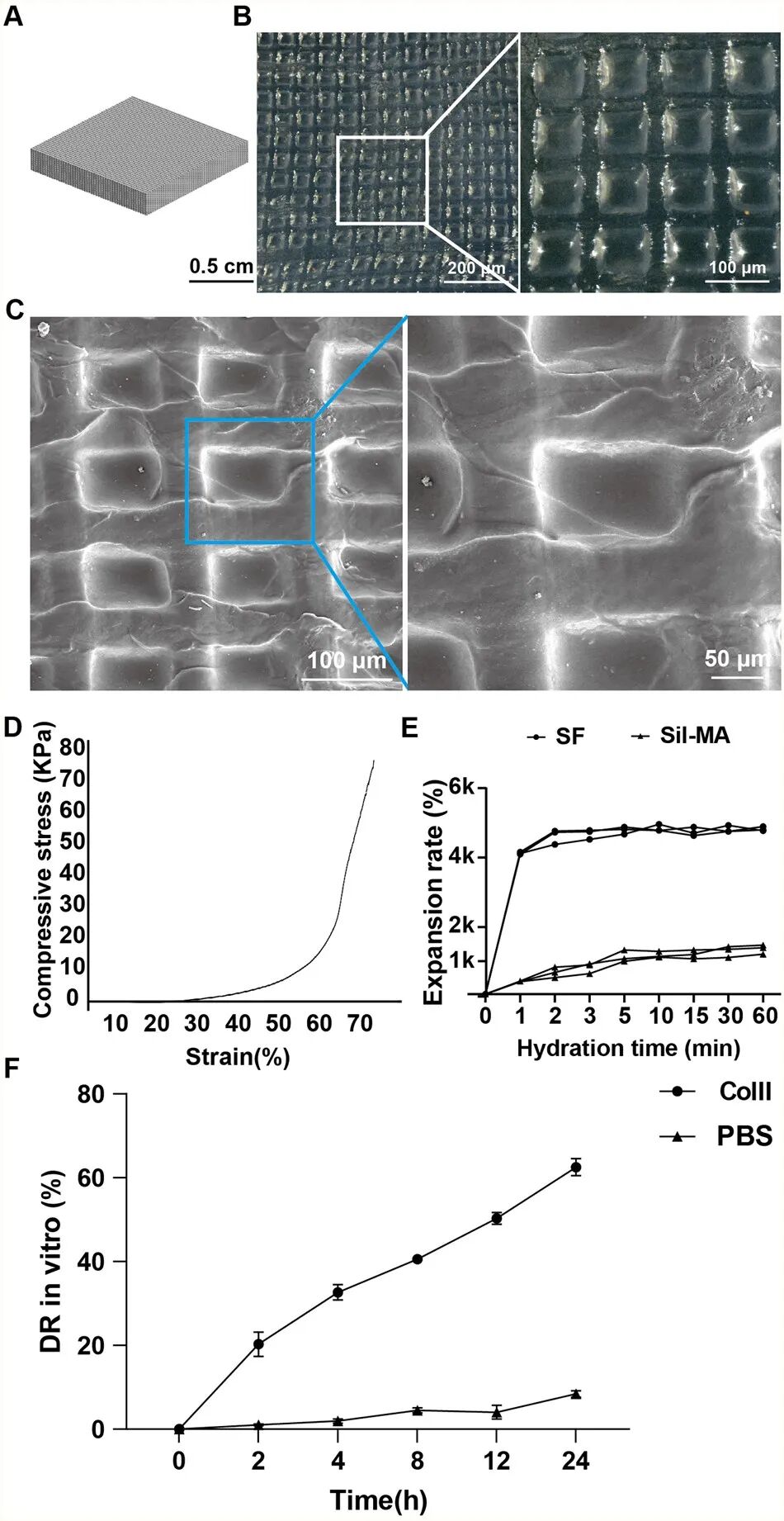
图2 3D-SF 支架的表征
将 ADSCs 植入 3D-SF 后,细胞能够在三维多孔结构中实现均匀黏附与深度浸润,并呈现出良好的铺展形态和增殖活性。随着培养时间延长,ADSCs 不仅沿孔壁迁移并形成细胞聚集体,还逐渐向支架内部浸润,表明 3D-SF 可为细胞提供利于气体及营养交换的立体微环境。CMFDA/PI 与 CCK-8 检测一致表明,支架内细胞存活率显著提高,活细胞比例自第1天至第7天持续增加,死亡细胞极少,说明 3D-SF具有优异的细胞相容性(图3)。在成肝诱导条件下培养ADSCs@3D-SF可以发现,ADSCs 上调 AFP、ALB、CYP1A1、CK18、CK19 等肝细胞特异标志物的基因与蛋白表达,体现出稳定的成肝细胞样细胞分化趋势。上述结果共同表明,3D-SF 不仅可以支持 ADSCs 的黏附、生长与迁移,还能显著促进ADSCs 在三维环境下向肝细胞样细胞方向分化,具备良好的生物活性与诱导响应能力,为后续肝组织修复奠定基础。
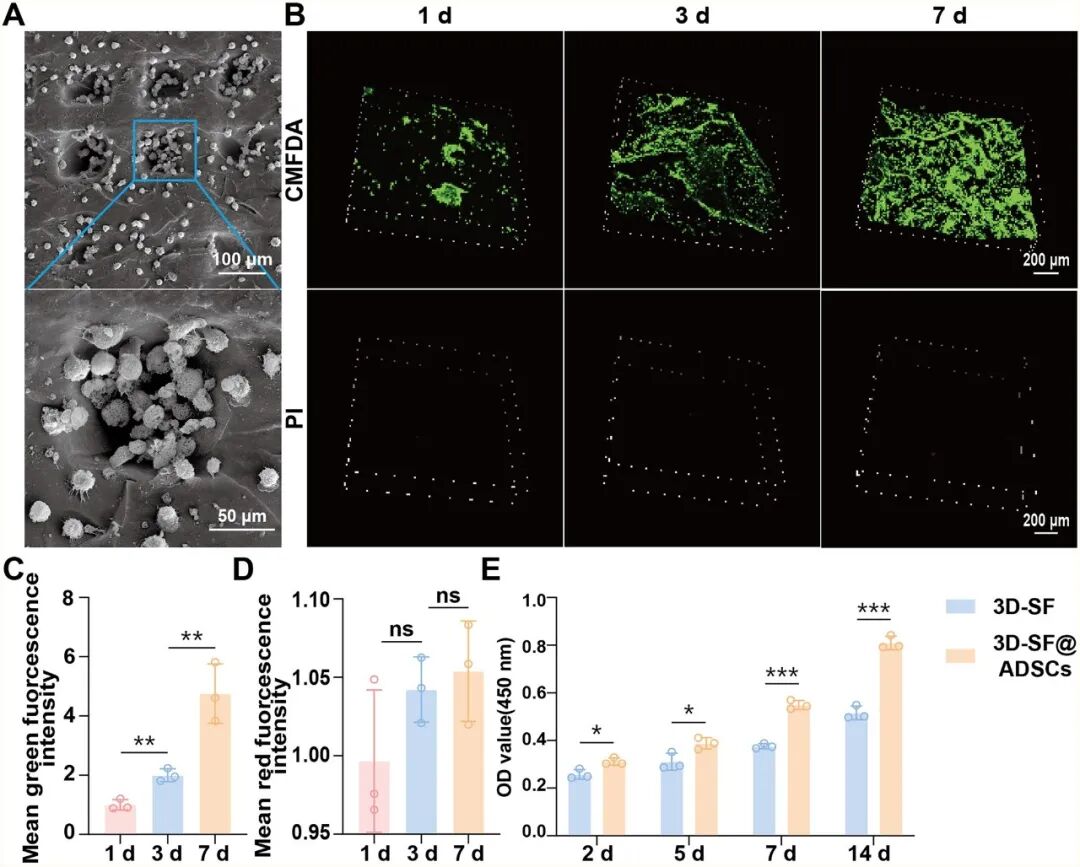
图3 ADSCs@3D-SF 的体外生物相容性表征
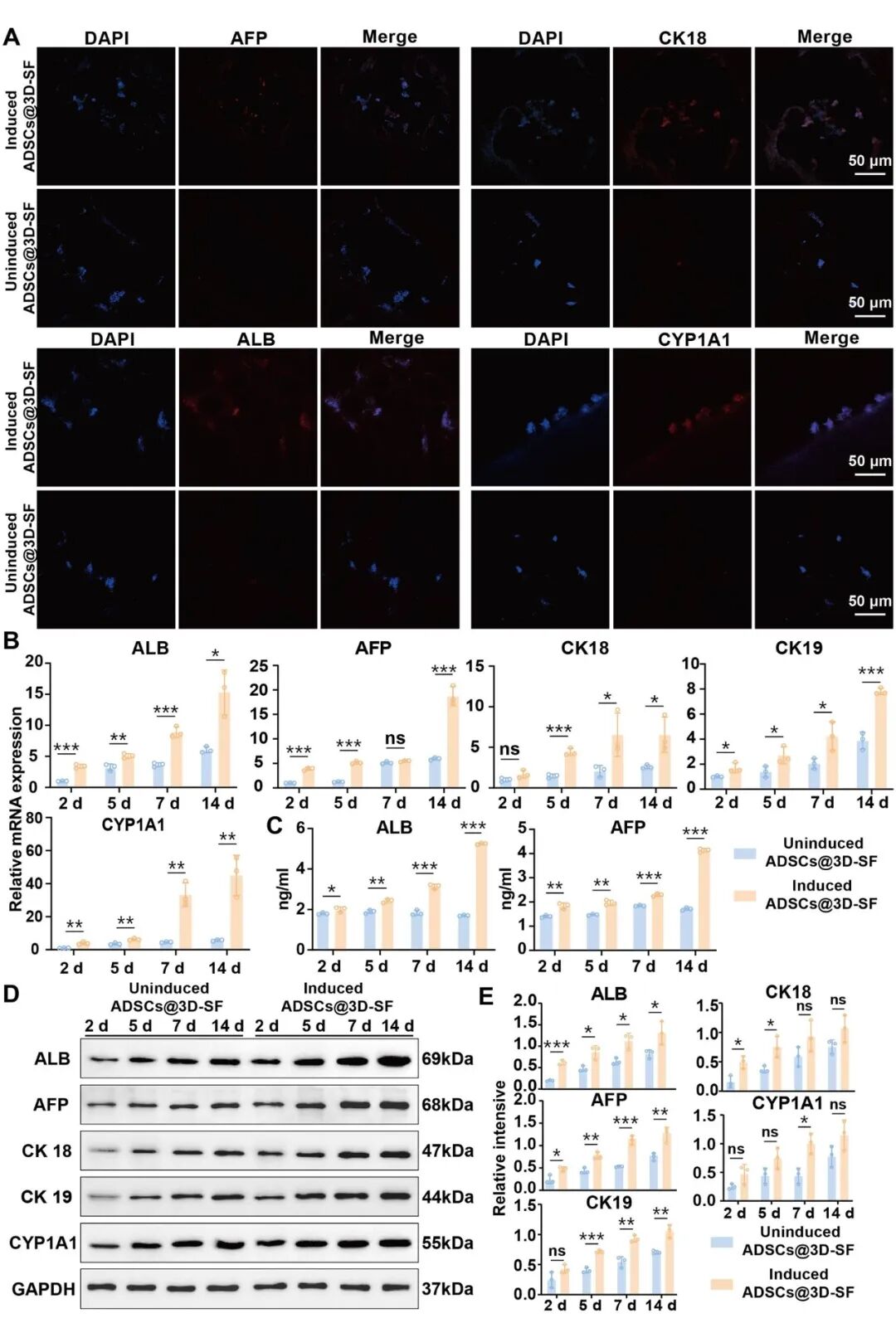
图4 3D-SF 支架上培养的 ADSCs 可在体外成肝诱导条件下向肝细胞样细胞分化
在体内实验中,将 3D-SF 、ADSCs@3D-SF 植入急性肝损伤小鼠肝脏表面后,对小鼠体重变化的监测可以发现,ALI 组体重持续下降并仅在后期略有回升,而 3D-SF 与 ADSCs@3D-SF 组在早期短暂下降后逐渐恢复并超过基线水平,其中 ADSCs@3D-SF 组回升最为显著(图5)。通过对ALI小鼠受损肝脏进行病理学及血生化分析可以发现,本研究成功建立了ALI小鼠模型(图6)。随后,对肝脏修复效果进行动态评估显示,支架在肝脏表面逐渐降解并与宿主组织紧密融合,展现出良好的体内生物相容性。此外,与对照相比,支架移植组均可改善肝损伤,且ADSCs@3D-SF组疗效更为显著。主要表现为血清 ALT、AST 水平均明显下降,ALB 水平逐步回升,肝功能恢复较快;同时,HE 染色结果显示,ADSCs@3D-SF 组肝组织的病变得到显著改善:脂肪变性等病理改变的范围明显缩小,炎症细胞浸润程度显著降低(图 7,图 8)。免疫组化染色观察到支架与肝脏交界区出现ARG1阳性肝脏修复、CD34、ERG 阳性血管样结构及 CK19 、MUC1阳性胆管样结构(图9),表明ADSCs@3D-SF不仅促进肝组织修复,还支持血管与胆道结构重建。
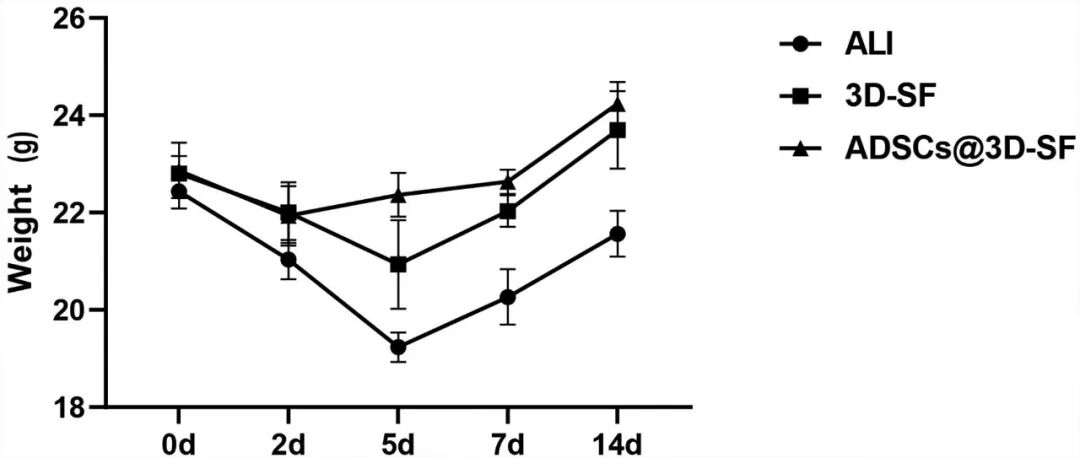
图5 支架移植后各组小鼠体质量变化情况
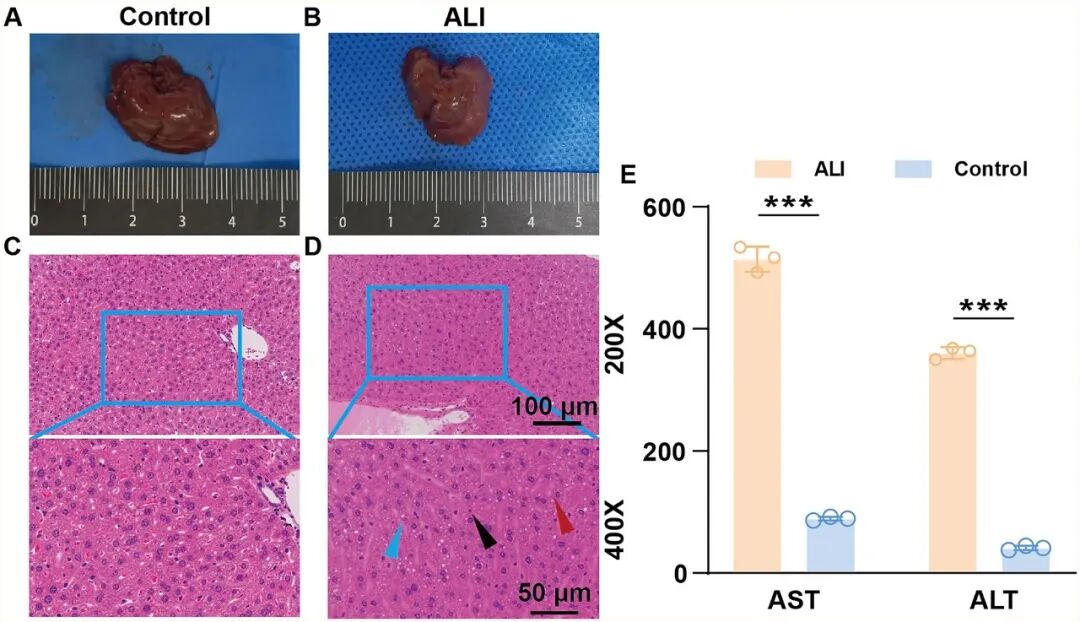
图6 急性肝损伤小鼠模型成功建立
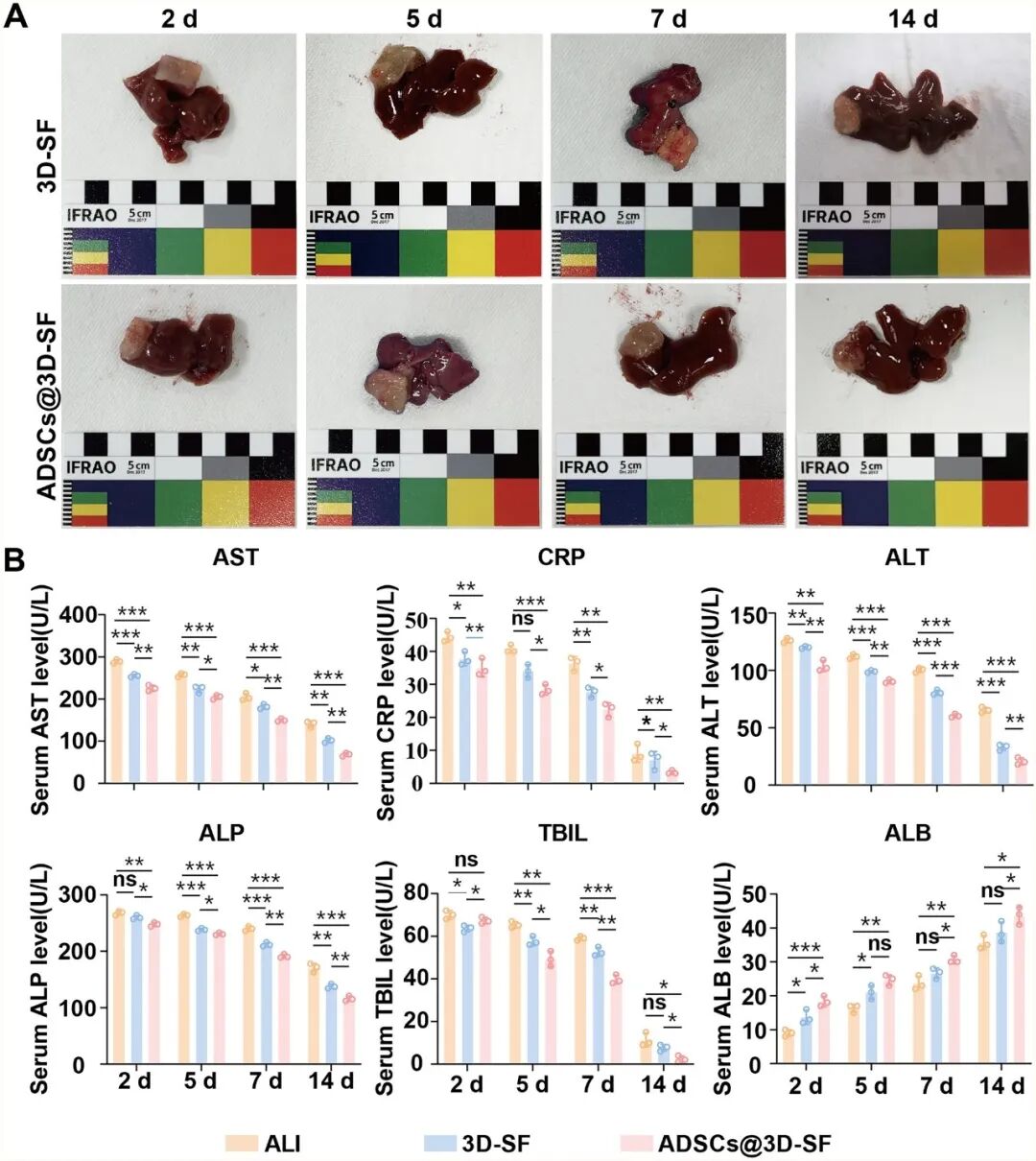
图7 3D-SF 在体内具有促进急性肝损伤修复的功能
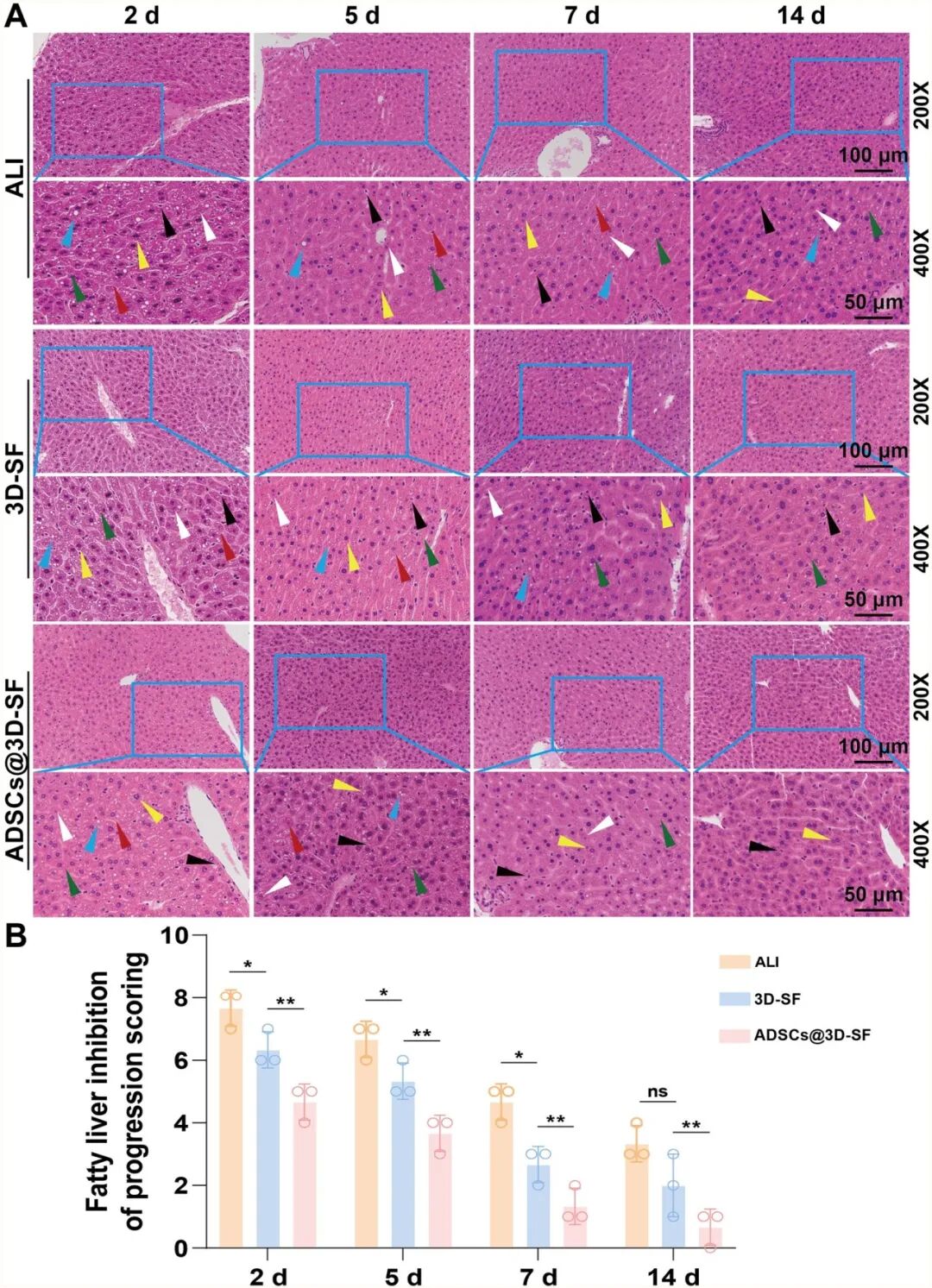
图8 3D-SF修复小鼠急性肝损伤的组织病理学分析
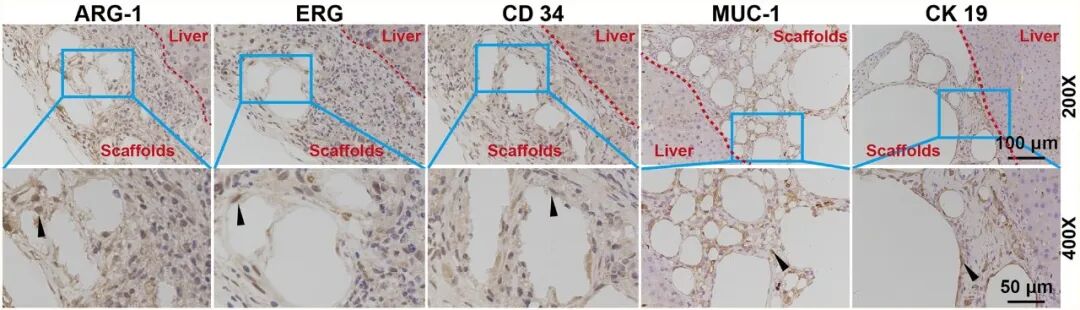
图9 在支架与肝脏连接处观察到新生结构的生成
转录组学分析显示,与ALI组相比,支架移植后Wnt信号通路被显著激活(图10)。进一步的验证表明,该通路中的关键因子β-Catenin及其下游靶标LEF-1和Cyclin D1在基因和蛋白水平的表达均显著上调,同时增殖细胞(Ki67+)数量也明显增加(图11)。这些结果共同表明,ADSCs@3D-SF可以通过激活Wnt/β-catenin信号通路,促进细胞增殖,在分子层面阐明了ADSCs@3D-SF修复急性肝损伤的核心机制。
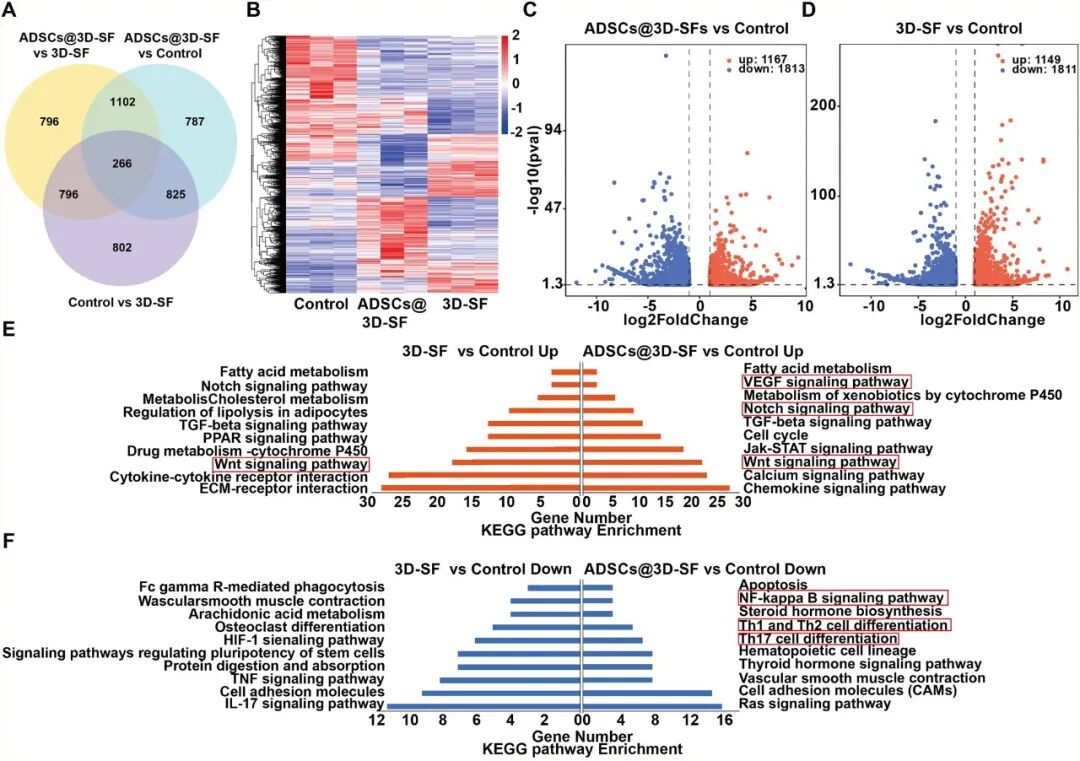
图10 肝组织-支架交界处的RNA测序分析
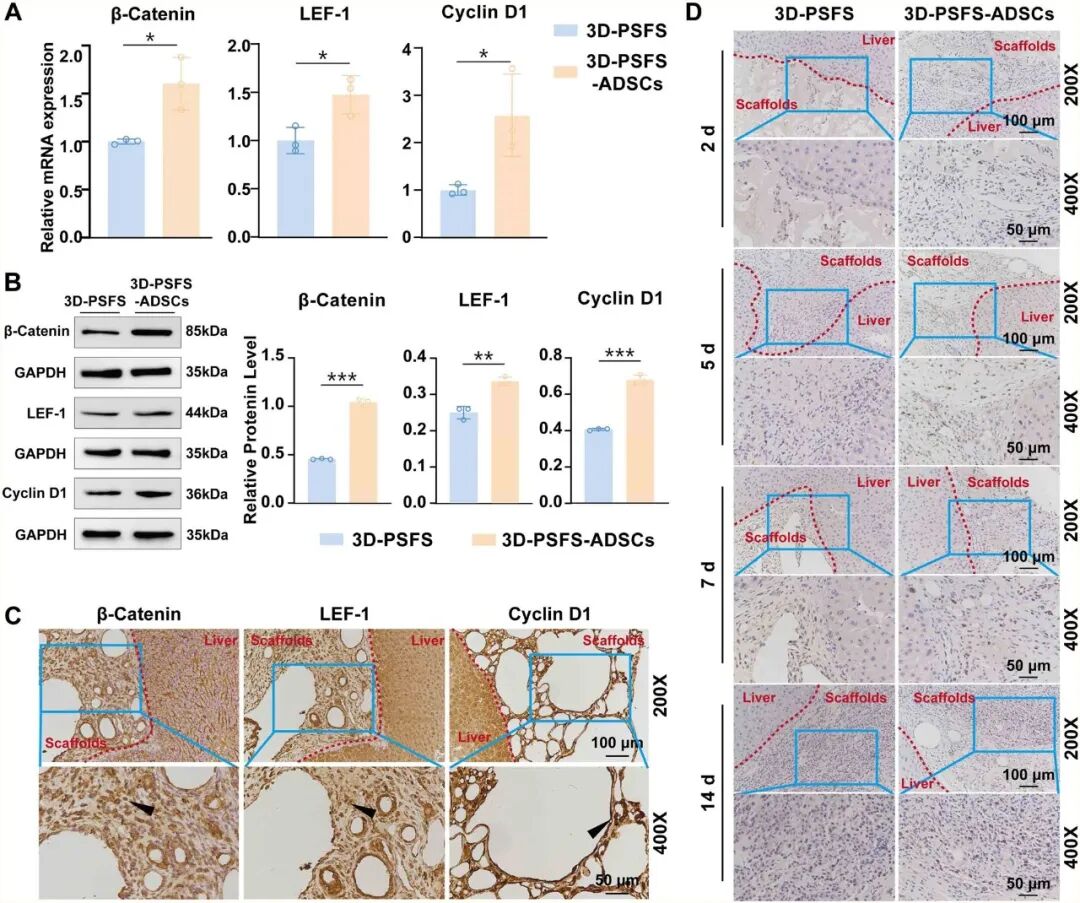
图11 Wnt通路在ADSCs@3D-SF内部细胞中高度激活
本研究为治疗ALI提供了新的见解。3D-SF具有良好的生物相容性、生物稳定性和力学性能,可以促进ADSCs成肝细胞样细胞分化,ADSCs可以显著提高3D-SF治疗ALI的效率。3D-SF有望成为治疗ALI的极具潜力的支架材料。
通讯作者
阎丽,中国人民解放军总医院教授、主任医师、博士生导师,第二医学中心老年医学科副主任。擅长消化系统相关疾病、自身免疫性疾病、消化道肿瘤及内镜诊治技术。担任海峡两岸医药卫生交流协会消化内镜分会委员。曾获干细胞移植治疗急慢性肝损伤研究获军队科技进步二等奖。
张耀鹏,东华大学先进纤维材料全国重点实验室教授、博士生导师。入选全球前2%顶尖科学家(2024年,2025年)、上海领军人才(2022年)、中国纺织学术带头人(2021年)、上海市优秀学术带头人(2020年)、上海市曙光学者(2015年)等。主要研究纤维素和丝素蛋白等生物质材料,在Adv.Mater.、ACS Nano.等期刊发表论文200余篇,曾获中国材料研究学会科学技术奖一等奖(2023年)、上海医学科技奖一等奖(2020年)、钱宝钧纤维材料奖青年学者奖(2021年)、中央军委科学技术委员会军队科技进步二等奖(2018年)等。
第一作者
论文共同第一作者分别为中国人民解放军总医院硕士生史潇楠、主治医师吴璇、博士生张大旭。
共同作者
本论文共同作者还有首都医科大学附属北京友谊医院副研究员杜风,浙江中医药大学博士生李三多,中国人民解放军总医院病理科主任王湛博、硕士生刘昱彤、李伟龙、赵烁、胡婧婧、叶淑君、王婧怡,东华大学博士生刘晓娇。
原文链接
DOI: https://doi.org/10.1093/rb/rbaf103

